गैस कानून
गैस कानून – संलग्न स्थान में गैस की स्थिति को तापमान के संदर्भ में व्यक्त किया जा सकता है, आयतन, और दबाव. परिमाण- उस राशि को राज्य चर कहा जाता है. अगर एक चर बदलता है, तब अन्य चर निर्धारित किए जा सकते हैं.
यह 18 वीं शताब्दी के अंत में था जब वैज्ञानिकों को संस्करणों के बीच संबंध का एहसास हुआ, गैस के नमूने से दबाव और तापमान प्राप्त किया जा सकता है, जो सभी गैसों के दृष्टिकोण के लिए आधार बनाता है, उन्होंने इसे विकसित करना शुरू किया.
इस अवसर पर YukSinau.co.id भौतिकी में गैस कानून के बारे में पूर्ण चर्चा करेगा, आइए निम्नलिखित स्पष्टीकरण पर विचार करें.
विषय - सूची
गैस कानून
गैस कानून एक कानून है जो गैस को कवर करता है, भौतिकी में कई गैस कानून हैं जो अक्सर उपयोग किए जाते हैं. इनमें बॉयल का नियम है, हुकुम गे-लुसाक, चार्ल्स लॉ, हुकुम बोयल-गे लुसाक, और कई अन्य आदर्श गैस कानून.
बाॅय्ल का नियम

बॉयल के नियम को पहली बार वर्ष में कहा गया था 1662, नाम के एक भौतिक विज्ञानी द्वारा रॉबर्ट बॉयल. Dengan memakai pengukur tekanan dan wadah volume variabel, hukum tersebut dapat di verifikasi dengan cara eksperimental.
Hukum Boyle berbunyi “Volume suatu gas berbanding terbalik dengan tekanan yang di berikan ketika suhu konstan”.
Hukum Boyle dapat dituliskam secara matematis menggunakan rumus berikut:
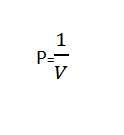
या
| P.V = Konstan |
Rumus diatas berlaku untuk gas yang kondisinya berbeda, tetapi dalam suhu yang sama, persamaan volume dan tekanannya dapat di tuliskan sebagai berikut :
| P1. वी1 = P2.वी2 |
जानकारी:
P1 = Tekanan gas keadaan 1 (कुंआ)
P2 = Tekanan gas keadaan 2 (कुंआ)
वी1 = गैस अवस्था का आयतन 1 (म3)
वी2 = गैस अवस्था का आयतन 2 (म3)
चार्ल्स लॉ

चार्ल्स लॉ, नामक भौतिक विज्ञानी द्वारा खोजा गया जाक चार्ल्स साल में 1787. चार्ल्स का नियम कहता है “दबाव के स्थिर होने पर गैस का आयतन उसके पूर्ण तापमान के सीधे आनुपातिक होता है& Ldquo;.
चार्ल्स के नियम को गणितीय रूप से निम्नलिखित सूत्र के साथ लिखा जा सकता है :
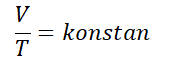
एक गैस के लिए जो संतुलन में है, तब कोई एक चर बदलता है, लेकिन दबाव बना हुआ है, समीकरण इस प्रकार लिखा जा सकता है.
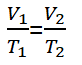
जानकारी:
वी1 = गैस अवस्था का आयतन 1 (म3)
वी2 = गैस अवस्था का आयतन 2 (म3)
टी1 = गैस तापमान की स्थिति 1 (क)
टी2 = गैस तापमान की स्थिति 2 (क)
हुकुम गे-लुसाक

हुकुम गे-लुसाक, या इसे अमोंटोन्स कानून भी कहा जाता है, एक कानून है जिसे एक भौतिक विज्ञानी द्वारा खोजा गया था जोसेफ लुई गे-लुसाक 1809 में गे-लुसैक का नियम पढ़ता है “वह एक निश्चित मात्रा में, गैस का दबाव उसके पूर्ण तापमान के समानुपाती होता है& Ldquo;.
गणितीय रूप से गे-लुसाक कानून को निम्नानुसार तैयार किया जा सकता है :
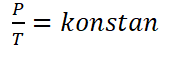
विभिन्न संतुलन की स्थितियों वाले गैसों के लिए, लेकिन एक निश्चित मात्रा में, गे-लुसाक का नियम निम्नानुसार तैयार किया जा सकता है.
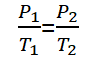
जानकारी :
P1 = Tekanan gas keadaan 1 (कुंआ)
P2 = Tekanan gas keadaan 2 (कुंआ)
टी1 = गैस तापमान की स्थिति 1 (क)
टी2 = गैस तापमान की स्थिति 2 (क)
हुकुम बोयल-गे लुसाक
बैग में तीन कानूनों को बॉयल-गे लुसाक के कानून के रूप में विलय किया जा सकता है, जो बॉयल के नियम का एक संयोजन है, चार्ल्स लॉ, और गे-लुसाक कानून.
ल्यूसैक का बॉयल-गे कानून निम्नानुसार तैयार किया जा सकता है.
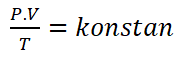
जानकारी :
पी = दबाव (कुंआ)
वि = मात्रा (म3)
टी = तापमान (क)संयुक्त कानून के निम्नलिखित महत्वपूर्ण परिणाम हैं:
संयुक्त गैस कानून के निम्नलिखित परिणाम हैं.
- जब दबाव और तापमान स्थिर होते हैं, तब उत्पादित गैस की मात्रा गैस के अणुओं की संख्या के बराबर होगी.
- जब तापमान और आयतन स्थिर रहे, फिर गैस के अणुओं की संख्या के बराबर गैस का दबाव कितना होगा.
- जब गैस अणुओं का तापमान और मात्रा स्थिर रहती है, तब मौजूदा दबाव आयतन के साथ पीछे चला जाता है.
- जब तापमान बदलता है तो गैस के अणुओं की मात्रा स्थिर रहती है, तब आयतन और दबाव बदल जाएगा.
अवोगाद्रो का नियम

अवोगाद्रो का कानून एक वैज्ञानिक द्वारा खोजे गए गैस कानूनों में से एक है अमेडियो अवोगाद्रो 1811 में। अवोगाद्रो का नियम पढ़ता है “आदर्श गैस द्वारा कब्जा की गई मात्रा टार कंटेनर में गैस अणु के समान हैकॉल & rdquo;

जानकारी :
वी1 = गैस अवस्था का आयतन 1 (म3)
वी2 = गैस अवस्था का आयतन 2 (म3)
n = गैस की मोल्स की संख्या
अन्य गैस कानून
उपरोक्त गैस कानून के अलावा कई अन्य गैस कानून भी हैं जैसे कि निम्नलिखित.
- ग्राहम का नियम, ग्राहम लॉ पढ़ता है "कि जिस दर पर विसरित गैस अणु एक निरंतर तापमान पर इसके घनत्व की वर्ग जड़ों का विरोध करेगा. एवरोगैडो के नियम के साथ संयोजन में यह कानून क्योंकि समान मात्रा में अणुओं की संख्या समान होगी, यह आणविक भार की जड़ के विपरीत है.
- डाल्टन का नियम, आंशिक दबाव के बारे में एक कानून है जो पढ़ता है “एक साधारण गैस संयुक्त दबाव उस दबाव के व्यक्तिगत घटकों से आने वाले आंशिक दबाव की मात्रा है& Ldquo;.
- हुकुम अमगत, एक कानून है जो आंशिक मात्रा से संबंधित है, अमगत का कानून पढ़ता है ” गैस मिश्रण की मात्रा या कंटेनर का आयतन मात्र कहा जाता हैज इन व्यक्तिगत घटकों से प्राप्त आंशिक मात्रा& Ldquo;. n के रूप में:
- हेनरी का नियम एक आवाज है “लगातार तापमान में, दी गई मात्रा और प्रकार के तरल में घुलने वाली गैस की मात्रा तरल में संतुलन में गैस में मौजूद आंशिक दबाव के समान होगी.& Rdquo;
इस प्रकार गैस कानूनों की हमारी चर्चा, उम्मीद है कि उपयोगी हो सकता है. अन्य भौतिकी सामग्री के बारे में जानने के लिए निम्नलिखित लेख देख सकते हैं.
अन्य लेख :
- गॉस का नियम
- लेनज का नियम
- विद्युत चुम्बकीय तरंग
- श्याम पिंडों से उत्पन्न विकिरण
- संभावित ऊर्जा सूत्र
- यूनिडायरेक्शनल इलेक्ट्रिक करंट
- ठोस पदार्थ
The post हुकुम-हुकुम तमांग गैस appeared first on YukSinau.co.id.
