Hukum-Hukum tentang Gas
Hukum-Hukum tentang Gas – Keadaan gas pada ruang tertutup dapat dinyatakan dengan besaran suhu, volume, dan tekanan. Besaran- besaran itu disebut variabel keadaaan. Jika salah satu variabel berubah, maka variabel yang lain dapat ditentukan.
Pada akhir abad ke-18 ketika para ilmuwan menyadari jika hubungan antara volume, tekanan dan suhu yang berasal dari suatu sampel gas bisa di dapatkan, yang dijadikan dasar bagi pendekatan semua gas, mereka mulai mengembangkannya.
Pada kesempatan kali ini YukSinau.co.id akan membahas secara lengkap tentang hukum gas dalam fisika, mari simak penjelasannya berikut ini.
İçindekiler
Hukum-Hukum Tentang Gas
Hukum hukum gas merupakan hukum yang mencakup tentang gas, dalam ilmu fisika ada beberapa hukum-hukum gas yang sering digunakan. Diantaranya adalah Hukum Boyle, Hukum Gay-Lussac, Hukum Charles, Hukum Boyle-Gay Lussac, dan beberapa hukum gas ideal lainnya.
Hukum Boyle

Hukum Boyle di kemukakan pertama kali di tahun 1662, oleh seorang ilmuwan fisika bernama Robert Boyle. Dengan memakai pengukur tekanan dan wadah volume variabel, hukum tersebut dapat di verifikasi dengan cara eksperimental.
Hukum Boyle berbunyi “Volume suatu gas berbanding terbalik dengan tekanan yang di berikan ketika suhu konstan”.
Hukum Boyle dapat dituliskam secara matematis menggunakan rumus berikut:
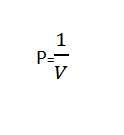
Atau
| P.V = Konstan |
Rumus diatas berlaku untuk gas yang kondisinya berbeda, tetapi dalam suhu yang sama, persamaan volume dan tekanannya dapat di tuliskan sebagai berikut :
| P1. V1 = P2.V2 |
Keterangan:
P1 = Tekanan gas keadaan 1 (Pa)
P2 = Tekanan gas keadaan 2 (Pa)
V1 = Volume gas keadaan 1 (m3)
V2 = Volume gas keadaan 2 (m3)
Hukum Charles

Hukum Charles, di temukan oleh ilmuwan fisika bernama Jacques Charles di tahun 1787. Hukum Charles menytakan “Volume gas berbanding lurus dengan suhu mutlaknya ketika tekanannya konstan“.
Hukum Charles adapat dituliskan secara matematis dengan rumus sebagai berikut :
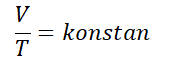
Untuk gas yang berada di dalam keadaan seimbang, kemudian salah satu variabel yang berubah, namun tekanannya tetap, persamaan tersebut dapat ditulisakan sebagai berikut.
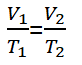
Keterangan:
V1 = Volume gas keadaan 1 (m3)
V2 = Volume gas keadaan 2 (m3)
T1 = Suhu gas keadaan 1 (K)
T2 = Suhu gas keadaan 2 (K)
Hukum Gay-Lussac

Hukum Gay-Lussac, atau di sebut juga dengan hukum Amontons, adalah hukum yang ditemukan oleh ilmuwan fisika yang bernama Joseph Louis Gay-Lussac di tahun 1809. Hukum Gay-Lussac berbunyi “Bahwa pada volume tetap, tekanana gas berbanding lurus dengan suhu mutlaknya“.
Secara matematis Hukum Gay-Lussac dapat dirumuskan sebagai berikut :
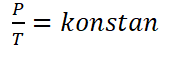
Untuk gas yang mempunyai keadaan kesetimbangan yang berbeda, tetapi pada volume tetap, hukum Gay-Lussac dapat dirumuskan seperti berikut.
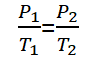
Keterangan :
P1 = Tekanan gas keadaan 1 (Pa)
P2 = Tekanan gas keadaan 2 (Pa)
T1 = Suhu gas keadaan 1 (K)
T2 = Suhu gas keadaan 2 (K)
Hukum Boyle-Gay Lussac
Ketiga hukum di tas dapat di gabung menjadi Hukum Boyle-Gay Lussac, yang merupakan gabungan dari Hukum Boyle, Hukum Charles, dan Hukum Gay-Lussac.
Hukum Boyle-Gay Lussac dapat di rumuskan sebagai berikut.
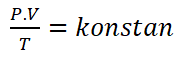
Keterangan :
P = Tekanan (Pa)
V = Volume (m3)
T = Suhu (K)Hukum gabungan memiliki konsekuensi penting sebagai berikut:
Hukum gas gabungan mempunyai beberapa konsekuensi sebagai berikut.
- Apabila tekanan dan suhu dalam kedaan konstan, maka volume gas yang dihasilkan akan sama dengan jumlah molekul gas.
- Apabila suhu dan volume tetap dalam keadaan konstan, maka tekanan yang ada pada perubahan gas akan sama dengan jumlah molekul gas tersebut.
- Apabila suhu dan jumlah molekul gas tetap konstan, maka tekanan yang ada akan bertolak belakang dengan volume.
- Apabila suhu berubah tetapi jumlah molekul gas dalam keadaan konstan, maka volume dan tekanan akan berubah.
Hukum Avogadro

Hukum Avogadro merupakan salah satu hukum-hukum gas yang ditemukan oleh ilmuwan yang bernama Amedeo Avogadro di tahun 1811. Hukum Avogadro berbunyi “volume yang ditempati gas ideal sama dengan molekul gas yang berada di dalam wadah tersebut”.

Keterangan :
V1 = Volume gas keadaan 1 (m3)
V2 = Volume gas keadaan 2 (m3)
N = Jumlah mol gas
Hukum Gas Lain
Selain Hukum-Hukum tentang Gas diatas ada beberapa hukum gas lainnya seperti berikut ini.
- Hukum Graham, Hukum Graham berbunyi “bahwa laju saat molkeul gas yang mengalami difusi akan bertolak belakang dengan akar-akar kuadrat densitasnya di dalam suhu konstan. Hukum teresebut dalam dikombinasikan dengan hukum Avrogado karena volume yang sama akan mempunyai jumlah molekul yang juga sama, hal tersebut sama dengan bertolak belakang terhadap akar berat molekul tersebut.
- Hukum Dalton, adalah hukum tentang tekanan parsial yang berbunyi “bahwa tekanan gabungan gas yang sederhana adalah jumlah tekanan parsial yang berasal dari komponen individual tekanan tersebut“.
- Hukum Amagat, adalah hukum yang membahas tentang volume parsial, hukum Amagat berbunyi ” Volume dari campuran gas atau volume dari suatu wadah secara sederhana adalah volume-volume parsial yang berasal dari komponen individual tersebut“. n sebagai:
- Hukum Henry mempunyai bunyi “Dalam suhu konstan, jumlah gas yang terlarut di dalam volume dan jenis cairan yang diberikan akan sama dengan tekana parsial yang ada pada gas tersebut dalam kesetimbangan di dalam cairan tersebut.”
Demikianlah pembahasan kita tentang Hukum-Hukum Gas, semoga dapat bermanfaat. Untuk mengetahui tentang materi Fisika lainnya dapat mengunjungi artikel di berikut ini.
Diğer Makaleler :
- Hukum Gauss
- Hukum Lenz
- Elektromanyetik Dalgalar
- Radiasi Benda Hitam
- Rumus Energi Potensial
- Doğrudan Elektrik Akımı
- Zat Padat
The post Hukum-Hukum tentang Gas appeared first on YukSinau.co.id.
