Lois sur le gaz
Lois sur le gaz – L'état du gaz dans l'espace clos peut être exprimé en termes de température, le volume, et la pression. Ordre de grandeur- ce montant est appelé la variable d'état. Si une variable change, alors d'autres variables peuvent être déterminées.
C'est à la fin du XVIIIe siècle que les scientifiques ont réalisé la relation entre les volumes, la pression et la température d'un échantillon de gaz peuvent être obtenues, qui constitue la base de l'approche de tous les gaz, ils ont commencé à le développer.
A cette occasion, YukSinau.co.id discutera en détail de la loi des gaz en physique, considérons l'explication suivante.
Table des matières
Lois sur le gaz
La loi sur le gaz est une loi qui couvre le gaz, en physique, il existe plusieurs lois sur les gaz qui sont souvent utilisées. Parmi eux, la loi de Boyle, Hukum Gay-Lussac, Charles Law, Hukum Boyle-Gay Lussac, et plusieurs autres lois sur les gaz parfaits.
La loi de Boyle

La loi de Boyle a été déclarée pour la première fois dans l'année 1662, par un physicien nommé Robert Boyle. En utilisant un manomètre et un récipient à volume variable, la loi peut être vérifiée de manière expérimentale.
La loi de Boyle se lit "Le volume d'un gaz est inversement proportionnel à la pression appliquée lorsque la température est constante”.
La loi de Boyle peut être écrite mathématiquement en utilisant la formule suivante:
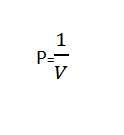
Ou
| P.V = Constante |
La formule ci-dessus s'applique au gaz avec des conditions différentes, mais à la même température, l'équation de volume et de pression peut s'écrire comme suit :
| P1. V1 = P2.V2 |
Information:
P1 = Pression du gaz d'état 1 (bien)
P2 = Pression du gaz d'état 2 (bien)
V1 = Volume de l'état du gaz 1 (m3)
V2 = Volume de l'état du gaz 2 (m3)
Charles Law

Charles Law, découvert par un physicien nommé Jacques Charles dans l'année 1787. La loi de Charles stipule “Le volume d'un gaz est directement proportionnel à sa température absolue lorsque la pression est constante& ldquo;.
La loi de Charles peut être écrite mathématiquement avec la formule suivante :
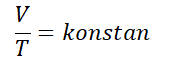
Pour un gaz en équilibre, puis l'une des variables change, mais la pression reste, l'équation peut être écrite comme suit.
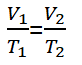
Information:
V1 = Volume de l'état du gaz 1 (m3)
V2 = Volume de l'état du gaz 2 (m3)
T1 = Condition de température du gaz 1 (K)
T2 = Condition de température du gaz 2 (K)
Hukum Gay-Lussac

Hukum Gay-Lussac, ou aussi appelé loi Amontons, est une loi qui a été découverte par un physicien nommé Joseph Louis Gay-Lussac en 1809. La loi de Gay-Lussac lit “Cela à un volume fixe, la pression du gaz est proportionnelle à sa température absolue& ldquo;.
Mathématiquement, la loi Gay-Lussac peut être formulée comme suit :
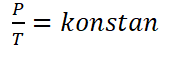
Pour les gaz ayant des conditions d'équilibre différentes, mais à un volume fixe, La loi de Gay-Lussac peut être formulée comme suit.
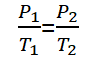
Information :
P1 = Pression du gaz d'état 1 (bien)
P2 = Pression du gaz d'état 2 (bien)
T1 = Condition de température du gaz 1 (K)
T2 = Condition de température du gaz 2 (K)
Hukum Boyle-Gay Lussac
Les trois lois du sac peuvent être fusionnées en tant que loi de Boyle-Gay Lussac, qui est une combinaison de la loi de Boyle, Charles Law, et loi Gay-Lussac.
La loi Boyle-Gay de Lussac peut être formulée comme suit.
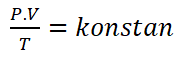
Information :
P = pression (bien)
V = Volume (m3)
T = température (K)La loi combinée a les conséquences importantes suivantes:
La loi combinée sur le gaz a les conséquences suivantes.
- Lorsque la pression et la température sont constantes, alors le volume de gaz produit sera égal au nombre de molécules de gaz.
- Lorsque la température et le volume restent constants, alors la pression à laquelle les changements de gaz seront égaux au nombre de molécules du gaz.
- Lorsque la température et la quantité de molécules de gaz restent constantes, alors la pression existante recule avec le volume.
- Lorsque la température change, la quantité de molécules de gaz reste constante, alors le volume et la pression changeront.
Loi d'Avogadro

La loi d'Avogadro est l'une des lois sur les gaz découvertes par un scientifique nommé Amedeo Avogadro en 1811. La loi d'Avogadro lit “le volume occupé par le gaz idéal est le même que la molécule de gaz dans le réservoir de goudronappeler & rdquo;

Information :
V1 = Volume de l'état du gaz 1 (m3)
V2 = Volume de l'état du gaz 2 (m3)
n = Nombre de moles de gaz
Autres lois sur le gaz
Outre les lois sur le gaz ci-dessus, il existe plusieurs autres lois sur le gaz, telles que les suivantes:.
- Loi de Graham, La loi de Graham dit "que la vitesse à laquelle la molécule de gaz diffusée contredira les racines carrées de sa densité à température constante. La loi est combinée avec la loi d'Avrogado car le même volume aura le même nombre de molécules, c'est l'opposé de la racine du poids moléculaire.
- Loi de Dalton, est une loi sur la pression partielle qui se lit “qu'une simple pression combinée de gaz est la quantité de pression partielle provenant des composants individuels de cette pression& ldquo;.
- Hukum Amagat, est une loi qui traite des volumes partiels, La loi d'Amagat se lit ” Le volume d'un mélange gazeux ou le volume d'un récipient est simplement dith volumes partiels dérivés de ces composants individuels& ldquo;. n as:
- La loi d'Henry a un son “À température constante, la quantité de gaz dissous dans le volume et le type de liquide donné sera la même que la pression partielle présente dans le gaz en équilibre dans le liquide.& rdquo;
Ainsi, notre discussion sur les lois du gaz, je l'espère, peut être utile. Pour en savoir plus sur d'autres matériaux de physique, visitez l'article suivant.
Autres articles :
- Loi de Gauss
- Loi de Lenz
- Onde électromagnétique
- Rayonnement du corps noir
- Formule énergétique potentielle
- Courant électrique unidirectionnel
- Substance solide
Le post Hukum-Hukum tentang Gas est apparu en premier sur YukSinau.co.id.
