Legge nantu à u gasu
Legge nantu à u gasu – U statu di u gasu in u spaziu chjusu pò esse spressu in termini di temperatura, voluminu, è a prissioni. Magnitudine- quella quantità hè chjamata variabile di statu. Se una variabile cambia, poi altri variabili ponu esse determinati.
Hè stata à a fine di u 18u seculu quandu i scientifichi anu rializatu a relazione trà volumi, a pressione è a temperatura da una mostra di gas pò esse uttenuta, chì forma a basa per l'approcciu di tutti i gasi, cumincianu à sviluppà.
In questa occasione YukSinau.co.id discutarà in pienu circa a lege di u gas in fisica, cunsideremu a seguente spiegazione.
Indice
Legge nantu à u gasu
A lege di u gasu hè una legge chì copre u gasu, in fisica ci sò parechji leggi di gas chì sò spessu usati. À mezu à elli hè a Lei di Boyle, Hukum Gay-Lussac, Ghjucidiu Carlu, Hukum Boyle-Gay Lussac, è parechji altre leggi ideali di gasu.
A leggi di Boyle

A lege di Boyle hè stata prima dichjarata in l'annu 1662, da un fisicu chjamatu Robert Boyle. Utilizendu un manometru è un cuntainer di volumi variàbili, a lege pò esse verificatu in modu sperimentale.
A lege di Boyle leghje "U voluminu di un gas hè inversamente proporzionale à a pressione appiicata quandu a temperatura hè custante”.
A legge di Boyle pò esse scritta matimaticamente usendu a seguente formula:
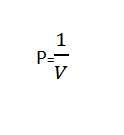
O
| P.V = Custante |
A formula sopra si applica à u gas cù diverse cundizioni, ma à a stessa temperatura, l'equazione di voluminu è di pressione pò esse scritta cum'è seguente :
| P1. V1 = P2.V2 |
Infurmazioni:
P1 = Pressione di gas di Statu 1 (Ebbè)
P2 = Pressione di gas di Statu 2 (Ebbè)
V1 = Volume di statu di gas 1 (m3)
V2 = Volume di statu di gas 2 (m3)
Ghjucidiu Carlu

Ghjucidiu Carlu, scopre da un fisicu chjamatu Ghjacumu Carlu in annu 1787. A lege di Charles dice “U voluminu di un gasu hè direttamente proporzionale à a so temperatura assoluta quandu a pressione hè custante& ldquo;.
A lege di Charles pò esse scritta matematicamente cù a formula seguente :
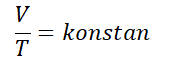
Per un gas chì hà in equilibriu, allora una di e variabili cambià, ma a pressione ferma, l'equazione pò esse scritta cum'è seguente.
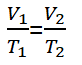
Infurmazioni:
V1 = Volume di statu di gas 1 (m3)
V2 = Volume di statu di gas 2 (m3)
T1 = Cundizione temperatura di gas 1 (K)
T2 = Cundizione temperatura di gas 2 (K)
Hukum Gay-Lussac

Hukum Gay-Lussac, o ancu chjamatu a lege Amontons, hè una lege chì hè stata scuperta da un fisicu chjamatu Ghjiseppu Louis Gay-Lussac in u 1809. A leggi di Gay-Lussac leghje “Quellu à un volumu fissu, a pressione di u gasu hè proporzionale à a so temperatura assoluta& ldquo;.
Matematicamente a Legge Gay-Lussac pò esse furmulata cum'è seguente :
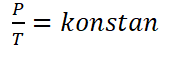
Per i gasi chì anu cundizioni d'equilibriu differenti, ma à un volumu fissu, A lege di Gay-Lussac pò esse furmulata cum'è seguente.
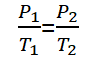
Infurmazioni :
P1 = Pressione di gas di Statu 1 (Ebbè)
P2 = Pressione di gas di Statu 2 (Ebbè)
T1 = Cundizione temperatura di gas 1 (K)
T2 = Cundizione temperatura di gas 2 (K)
Hukum Boyle-Gay Lussac
E trè lege in u saccu ponu esse unite cum'è a lege di Boyle-Gay Lussac, chì hè una cumminazione di Boyle's Law, Ghjucidiu Carlu, è a Legge Gay-Lussac.
A legge Boyle-Gay di Lussac pò esse furmulata cum'è seguente.
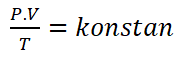
Infurmazioni :
P = Prissioni (Ebbè)
V = Volum (m3)
T = Temperatura (K)A legge cumminata hà e seguenti cunsequenze impurtanti:
A legge cumminata di gas hà e seguenti cunsequenze.
- Quandu a pressione è a temperatura sò custanti, allura u voluminu di gasu pruduttu serà uguali à u numeru di molécule di gas.
- Quandu a temperatura è u voluminu restanu custanti, poi a pressione induve u cambiamentu di u gasu sarà uguali à u numeru di molécule di u gasu.
- Quandu a temperatura è a quantità di molécule di gas restanu custanti, allura a prissioni esistente torna in ritornu cù u voluminu.
- Quandu a temperatura cambia a quantità di molécule di gas ferma constante, allura u voluminu è a pressione cambianu.
A Lei di Avogadro

A lege di Avogadro hè una di e lege di u gasu scopre da un scientistu chjamatu Amedeo Avogadro in u 1811. A Legge di Avogadro leghje “u voluminu occupatu da u gasu ideale hè u listessu cum'è a molécula di gas in u cuntainer di tarchjamate & rdquo;

Infurmazioni :
V1 = Volume di statu di gas 1 (m3)
V2 = Volume di statu di gas 2 (m3)
n = Numru di moles di gas
Altri leggi nantu à u gasu
In più di e leggi di Gas sopra, ci sò parechje altre lege di gas cum'è e seguenti.
- A lege di Graham, A legge di Graham lee "chì a velocità à a quale a molécula di gas diffusa contradicà e radici quadrate di a so densità à una temperatura custanti. Questa legge in cunghjunzione cù a lege di Avrogado perchè u stessu volumu averà u stessu numeru di molecule, questu hè u cuntrariu di a radica di u pesu moleculare.
- A lege di Dalton, hè una lege nantu à a prissioni parziale chì leghje “chì una pressione simplica cumminata di gas hè a quantità di pressione parziale chì vene da i cumpunenti individuali di quella pressione& ldquo;.
- Hukum Amagat, hè una lege chì s'occupa di volumi parziali, A lege di Amagat leghje ” Si dice simplice u voluminu di una mistura di gasu o u voluminu di un containeruh volumi parziali derivati da sti cumpunenti individuali& ldquo;. n as:
- A lege di Enric hà un sonu “In temperatura custanti, a quantità di gas dissolutu in u voluminu è u tipu di liquidu datu serà a stessa cosa di a pressione parziale presente in u gasu in equilibriu in u liquidu.& rdquo;
Cusì a nostra discussione di e Liè di u Gas, speru puderà esse utile. Per sapè da altre materiale di Fisica pudete visità l'articulu seguenti.
Altri Articuli :
- A leggi di Gauss
- A lege di Lenz
- Onda elettromagnetica
- Radiazione di u corpu Neru
- Formula di energia potenziale
- Corrente Elettrica Unidirectionale
- Sustanza solida
U post Hukum-Hukum tentang Gas apparsu prima YukSinau.co.id.
