قوانين الغاز
قوانين الغاز – يمكن التعبير عن حالة الغاز في المساحة المغلقة من حيث درجة الحرارة, الصوت, والضغط. الحجم- يسمى هذا المبلغ متغير الحالة. إذا تغير متغير واحد, ثم يمكن تحديد المتغيرات الأخرى.
كان ذلك في نهاية القرن الثامن عشر عندما أدرك العلماء العلاقة بين المجلدات, يمكن الحصول على الضغط ودرجة الحرارة من عينة الغاز, الذي يشكل الأساس لمقاربة جميع الغازات, بدأوا في تطويره.
في هذه المناسبة ، سيناقش YukSinau.co.id بالكامل حول قانون الغاز في الفيزياء, دعنا نفكر في التفسير التالي.
جدول المحتويات
قوانين الغاز
قانون الغاز هو قانون يغطي الغاز, في الفيزياء هناك العديد من قوانين الغاز التي يتم استخدامها غالبًا. من بينها قانون بويل, Hukum Gay-Lussac, قانون تشارلز, Hukum Boyle-Gay Lussac, والعديد من قوانين الغازات المثالية الأخرى.
قانون بويل

جاء قانون بويل لأول مرة في العام 1662, من قبل فيزيائي اسمه روبرت بويل. باستخدام مقياس الضغط وحاوية ذات حجم متغير, يمكن التحقق من القانون بطريقة تجريبية.
يقرأ قانون بويل "إن حجم الغاز يتناسب عكسياً مع الضغط المطبق عندما تكون درجة الحرارة ثابتة”.
يمكن كتابة قانون بويل رياضيًا باستخدام الصيغة التالية:
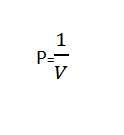
أو
| PV = ثابت |
تنطبق الصيغة أعلاه على الغاز بظروف مختلفة, ولكن في نفس درجة الحرارة, يمكن كتابة معادلة الحجم والضغط على النحو التالي :
| ص1. الخامس1 = ص2.الخامس2 |
معلومات:
ص1 = ضغط الغاز الحكومي 1 (حسنا)
ص2 = ضغط الغاز الحكومي 2 (حسنا)
الخامس1 = حجم حالة الغاز 1 (م3)
الخامس2 = حجم حالة الغاز 2 (م3)
قانون تشارلز

قانون تشارلز, اكتشفها فيزيائي يدعى جاك تشارلز في السنة 1787. ينص قانون تشارلز “يتناسب حجم الغاز بشكل مباشر مع درجة حرارته المطلقة عندما يكون الضغط ثابتًاو [لدقوو] ؛.
يمكن كتابة قانون تشارلز رياضياً بالصيغة التالية :
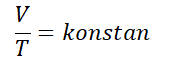
للغاز الموجود في حالة توازن, ثم يتغير أحد المتغيرات, لكن الضغط لا يزال قائما, يمكن كتابة المعادلة على النحو التالي.
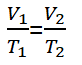
معلومات:
الخامس1 = حجم حالة الغاز 1 (م3)
الخامس2 = حجم حالة الغاز 2 (م3)
ت1 = حالة درجة حرارة الغاز 1 (ك)
ت2 = حالة درجة حرارة الغاز 2 (ك)
Hukum Gay-Lussac

Hukum Gay-Lussac, أو يسمى قانون Amontons, هو قانون اكتشفه فيزيائي يدعى جوزيف لويس جاي لوساك في عام 1809. يقرأ قانون غاي لوساك “أن بحجم ثابت, يتناسب ضغط الغاز مع درجة حرارته المطلقةو [لدقوو] ؛.
رياضيا يمكن صياغة قانون جاي لوساك على النحو التالي :
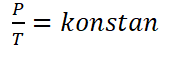
للغازات التي لها شروط توازن مختلفة, ولكن بحجم ثابت, يمكن صياغة قانون غاي لوساك على النحو التالي.
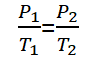
معلومات :
ص1 = ضغط الغاز الحكومي 1 (حسنا)
ص2 = ضغط الغاز الحكومي 2 (حسنا)
ت1 = حالة درجة حرارة الغاز 1 (ك)
ت2 = حالة درجة حرارة الغاز 2 (ك)
Hukum Boyle-Gay Lussac
يمكن دمج القوانين الثلاثة الموجودة في الحقيبة كقانون بويل-جاي لوساك, وهو مزيج من قانون بويل, قانون تشارلز, وقانون غاي لوساك.
يمكن صياغة قانون بويل-جاي من لوساك على النحو التالي.
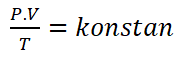
معلومات :
P = الضغط (حسنا)
V = الحجم (م3)
T = درجة الحرارة (ك)القانون المشترك له العواقب الهامة التالية:
قانون الغاز المشترك له النتائج التالية.
- عندما يكون الضغط ودرجة الحرارة ثابتة, عندها يكون حجم الغاز المنتج مساويا لعدد جزيئات الغاز.
- عندما تظل درجة الحرارة والحجم ثابتين, ثم الضغط الذي يتغير عنده الغاز يساوي عدد جزيئات الغاز.
- عندما تظل درجة حرارة وكمية جزيئات الغاز ثابتة, ثم يعود الضغط الحالي للخلف مع الحجم.
- عندما تتغير درجة الحرارة تبقى كمية جزيئات الغاز ثابتة, ثم سيتغير الحجم والضغط.
قانون أفوجادرو

قانون أفوغادرو هو أحد قوانين الغازات التي اكتشفها عالم يدعى أميديو أفوجادرو في عام 1811. قانون أفوجادرو يقرأ “الحجم الذي يشغله الغاز المثالي هو نفس جزيء الغاز في حاوية القطرانالاتصال و rdquo ؛

معلومات :
الخامس1 = حجم حالة الغاز 1 (م3)
الخامس2 = حجم حالة الغاز 2 (م3)
ن = عدد مولات الغاز
قوانين الغازات الأخرى
بالإضافة إلى قوانين الغاز أعلاه ، هناك العديد من قوانين الغاز الأخرى مثل ما يلي.
- قانون جراهام, يقرأ قانون غراهام "أن المعدل الذي يتعارض فيه جزيء الغاز المنتشر مع الجذور التربيعية لكثافته عند درجة حرارة ثابتة. يتم دمج القانون مع قانون Avrogado لأن نفس الحجم سيكون له نفس عدد الجزيئات, هذا عكس جذر الوزن الجزيئي.
- قانون دالتون, هو قانون حول الضغط الجزئي الذي يقرأ “أن الضغط البسيط للغاز هو مقدار الضغط الجزئي القادم من المكونات الفردية لذلك الضغطو [لدقوو] ؛.
- Hukum Amagat, هو قانون يتعامل مع مجلدات جزئية, يقرأ قانون Amagat ” ويقال ببساطة حجم خليط الغاز أو حجم الحاويةح أحجام جزئية مشتقة من هذه المكونات الفرديةو [لدقوو] ؛. ن مثل:
- قانون هنري لديه صوت “في درجة حرارة ثابتة, كمية الغاز المذاب في حجم ونوع السائل سيكون نفس الضغط الجزئي الموجود في الغاز في التوازن في السائل.و [ردقوو] ؛
وبالتالي مناقشتنا لقوانين الغاز, نأمل أن تكون مفيدة. لمعرفة المزيد عن مواد الفيزياء الأخرى ، يمكنك زيارة المقالة التالية.
مقالات أخرى :
- قانون غاوس
- قانون لينز
- موجه كهرومغناطيسية
- إشعاع الجسم الأسود
- صيغة الطاقة المحتملة
- التيار الكهربائي أحادي الاتجاه
- مادة صلبة
ظهر موقع Hukum-Hukum tentang Gas لأول مرة على YukSinau.co.id.
